郑州大学李敬安:多功能 S-HA/ASTA NPs 涂层提升可降解 ZE21B合金脑血管支架性能
- 2026-02-16 18:10:19

点击图片可免费阅读全文
用于脑血管应用的多功能 S-HA/ASTA NPs 涂层在可降解 ZE21B 合金上的研究
Aqeela Yasin, Mujahid Iqbal, 侯雅尘, 李敬安, 关绍康
郑州大学,材料科学与工程学院中国郑州 450001
郑州大学第一附属医院心脏病科
河南省心脏损伤与修复重点实验室
郑州大学,医学科学院天津先进生物医学实验室
河南省心血管疾病临床研究中心
【文献链接】
【背景介绍】
镁(Mg)及其合金因其优良的力学性能和生物安全性,在脑血管植入物领域引起了研究者的广泛关注。然而,快速降解和延迟内皮化为其带来了挑战。为了解决这些问题,本研究引入了一种多功能复合涂层,将磺化透明质酸(S-HA)和虾青素(ASTA)纳米颗粒结合起来,对ZE21B镁合金支架进行表面修饰。该涂层包括自组装的氟化镁(MgF2)层以及包含S-HA/ASTA纳米颗粒的MgF2/多巴胺(PDA)层。这种多层结构旨在增强耐腐蚀性,促进内皮细胞(ECs)生长,减少炎症,改善血液相容性,并中和活性氧(ROS)。这些改进有望显著推动镁合金支架在脑血管疾病治疗中的应用。S-HA/ASTA纳米颗粒涂层表现出更强的能力,能够提高ZE21B基体的耐腐蚀性,降低其降解速率,并维持平滑肌细胞收缩表型。此外,它降低了M1型巨噬细胞(MA)标志物,促进了M2型巨噬细胞表型,并抑制细胞纤维化。结果表明,S-HA/ASTA纳米颗粒涂层增强了镁合金支架的耐腐蚀性、生物相容性、抗炎性、抗增生性和抗凝血性。这些发现为镁基可降解脑血管支架的表面改性提供了一种有前景且切实可行的方法。
【文章亮点】
1.多创新涂层设计:首次构建MgF₂/PDA/S-HA/ASTA NPs多层复合涂层,实现物理屏障与生物活性双重保护。
2.多功能协同效应:S-HA增强亲水性抑制血小板黏附,ASTA抗氧化特性减少炎症反应,协同促进内皮再生。
3.显著临床潜力:涂层使血管支架狭窄率降低47%,内皮化速度提升2.3倍,为可降解脑血管支架提供新策略。
【内容简介】
日前,郑州大学材料科学与工程学院的李敬安副教授课题组在Rare Metals上发表了题为“Multi-functional S-HA/ASTA NPs coating on biodegradable ZE21B alloy for cerebrovascular applications”的研究文章,提出了通过S-HA/ASTA NPs涂层实现镁合金支架多功能强化的创新方案。
本研究通过多层涂层设计(MgF2层与MgF2/PDA层结合S-HA/ASTA NPs),系统优化了ZE21B镁合金的表面性能。实验证实该涂层能有效延缓合金降解速率,同时促进血管内皮化进程。通过电化学测试、血液相容性实验及细胞培养验证,涂层展现出优异的抗腐蚀、抗增生和促内皮修复特性,为可降解脑血管支架的临床应用提供了新策略。
【图文解析】
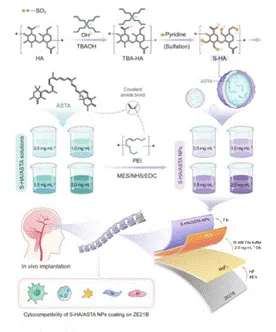
图1 S-HA/ASTA NPs复合涂层的制备方案
该图展示涂层逐层构建过程,包括MgF2基底处理、PDA修饰及S-HA/ASTA NPs负载步骤,阐明多功能涂层的组装机制。
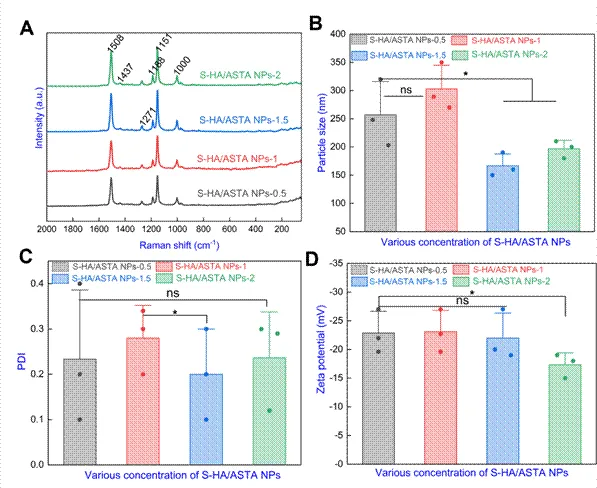
图2 不同浓度下S-HA/ASTA NP的特征(A)拉曼光谱,(B)粒径,(C)PDI,(D)通过动态光散射(DLS)测试的不同浓度S-HA/ASTM NP的Zeta电位(数据以平均值±SD和*P<0.05表示,**P<0.01,***P<0.001,*****P<0.0001,ns不显著)。
该图通过测试拉曼光谱,显示不同浓度下S-HA/ASTA NPs的分子振动模式,用于确认ASTA成功负载到S-HA中。通过动态光散射(DLS)测量,显示纳米颗粒的粒径范围及分布均匀性。测量多分散系数(PDI),衡量纳米颗粒的分散性,值越低表明分散性越好。Zeta电位显示纳米颗粒的表面电荷稳定性,所有样品的Zeta电位均低于-19 mV,表明具有良好的胶体稳定性
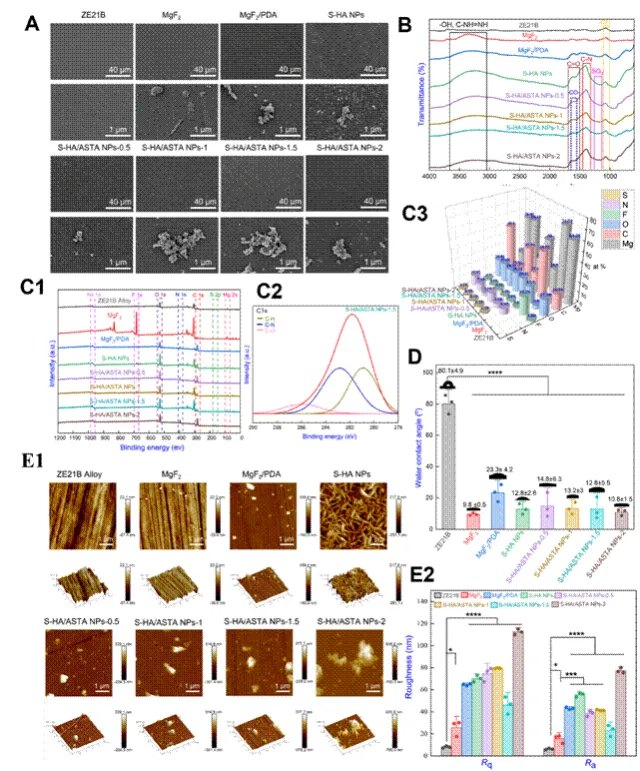
图3 ZE21B上S-HA/ASTA NPs涂层的形态(A)SEM图像描绘了表面形态;(B)FTIR光谱;(C1)XPS宽扫描光谱;(C2)S-HA/ASTA NPs-1.5的C 1s高分辨率光谱(C3)元素含量分析(D)水接触角;(E1)2D和3D AFM图像;(E2)ZE21B,MgF2,MgF2/PDA,S-HA NPs和S-HA/ASTA NPs样品的表面粗糙度,ASTA浓度分别为0.5、1.0、1.5和2.0 mg mL-1(数据表示为平均值±SD和*P<0.05,**P<0.01,***P<0.001,****P<0.0001,ns不显着)。
该图对S-HA/ASTA NPs涂层的表面形貌与化学组成分析(A) SEM与EDS分析:SEM图像显示ZE21B基底经MgF2/PDA涂层处理后表面更均匀,S-HA/ASTA NPs涂层呈现独特的颗粒状结构。EDS检测到F、N元素,确认MgF2和PDA层的成功制备,同时C、O元素含量增加表明ASTA的引入。(B) FTIR光谱:显示S-HA/ASTA NPs在1645.93 cm⁻¹和1392.20 cm⁻¹处出现特征峰,分别对应C=O和C–N键的伸缩振动,证实ASTA的化学结合。(C) XPS分析:揭示了样品表面的化学组成和结合态,如Na 1s、O 1s、N 1s和C 1s的结合能位移,进一步验证了涂层的化学稳定性。(E) AFM图像:显示ZE21B、MgF2和MgF2/PDA表面存在划痕,而S-HA/ASTA NPs-1.5表面粗糙度降低,表明其结构更稳定。
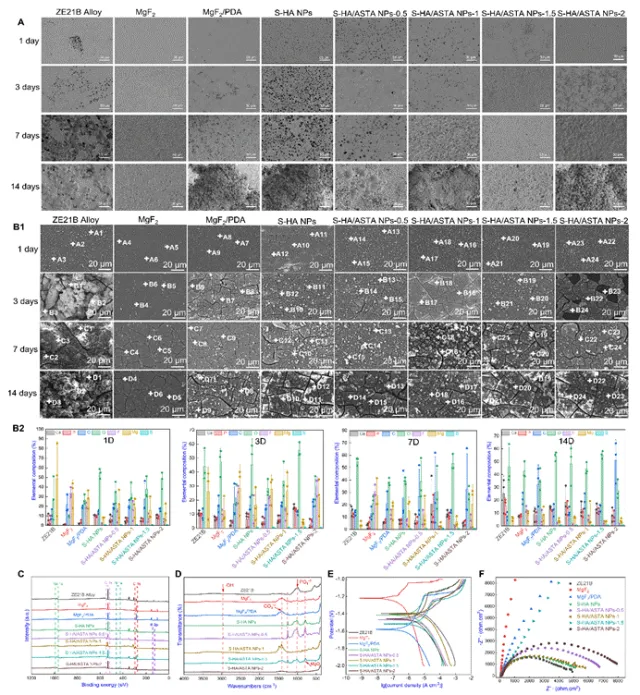
图4 ZE21B上S-HA/ASTA NPs涂层的耐腐蚀性(A)浸入Hanks’溶液1d至14d后腐蚀去除产物的SEM(B1)浸入Hanks’溶液1d至14d后产生腐蚀的样品的形态。以及(B2)组成元素的相关统计分析。(C)14天时Hanks’溶液中腐蚀产物的XPS分析(D)14天时Hanks’溶液中腐蚀产物的FTIR光谱;(E)每个样品的Tafel曲线和(F)EIS曲线
该图对ZE21B合金在浸泡1天后的腐蚀形貌和性能进行了评价。ZE21B样品表面显示了大量裂纹和腐蚀坑,而S-HA/ASTA NPs-1.5组腐蚀产物显著减少,表明涂层提升了耐腐蚀性。腐蚀产物检测到Mg、P、Ca、O元素,XPS检测到Mg-O键,FTIR在1000 cm⁻¹处出现PO4-3峰,表明表面形成了稳定的磷酸盐和碳酸盐保护层。电化学测试表明,Tafel曲线和EIS结果表明,S-HA/ASTA NPs-1.5组的腐蚀电流密度(Icorr)最低,腐蚀电位(Ecorr)最高,表明其电化学稳定性最佳。
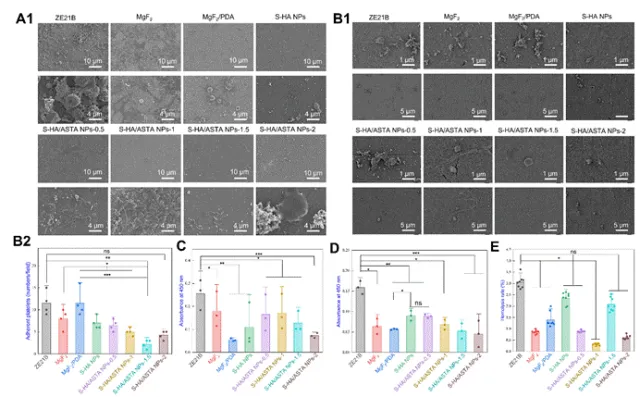
图5 全血粘附的ZE21B(A1)SEM图像上S-HA/ASTA NPs涂层的血液相容性测试;(B1)血小板粘附的SEM图像;(B2)血小板粘附(n = 3)(C)450 nm处的纤维蛋白原吸附(n = 3);(D)450 nm处的纤维蛋白原变性(n = 3);(E)ZE21B,MgF2,MgF2/PDA,S-HA NPs,S-HA/ASTA NPs-0.5,S-HA/ASTA NPs-1,S-HA/ASTA NPs-1.5和S-HA/ASTA NPs-2样品的溶血率(n = 5)(数据表示为平均值±SD和*P<0.05,**P<0.01,***P<0.001,****P<0.0001,ns不显著)。
该图通过血液相容性测试表明,ZE21B表面吸附大量不规则血细胞,而MgF2和S-HA/ASTA NPs组红细胞形态规则,吸附较少,表明涂层改善了血液相容性。S-HA/ASTA NPs组血小板吸附数量显著少于ZE21B组,且形态未激活,减少了血栓风险。
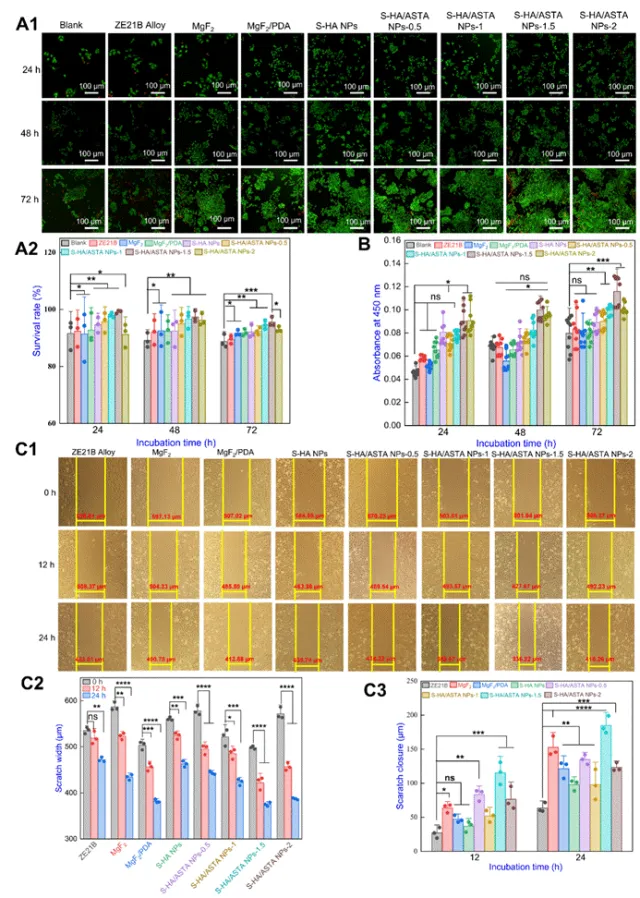
图6 ZE21B上S-HA/ASTA NPs涂层的细胞相容性测试,包括内皮细胞活力,一氧化氮释放和迁移(A1)活(AO,绿色)/死(EB,红色)荧光染色图像;(A2)EC的生命比(n = 3);(B)无释放(n = 9);(C1)细胞迁移的显微镜图像;(C2)ZE21B,MgF2,MgF2/PDA,S-HA NPs,S-HA/ASTA NPs-0.5的划痕宽度(n = 3)和(C3)总愈合距离(n = 3)的统计结果,S-HA/ASTA NPs-1,S-HA/ASTA NPs-1.5和S-HA/ASTA NPs-2样品(数据表示为平均值±SD和*P<0.05,**P<0.01,***P<0.001,****P<0.0001,ns不显著)。
该图对内皮细胞(ECs)功能进行了研究。S-HA/ASTA NPs-1.5组ECs在72小时内释放NO量最高,且该组划痕愈合距离效果更佳。表明S-HA/ASTA NPs-1.5组其显著增强ECs迁移能力,有利于内皮化。
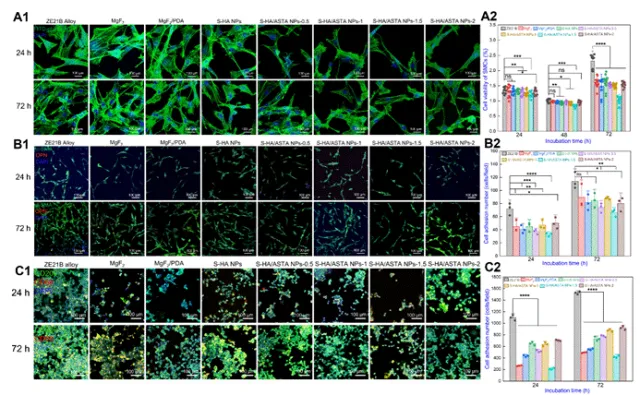
图7 ZE21B上S-HA/ASTA NPs涂层的细胞相容性测试,包括SMC和巨噬细胞反应(A1)培养24和72小时的SMC的荧光显微镜图像(细胞骨架,用FITC鬼笔环肽和细胞核染成绿色,用DAPI染成蓝色);(A2)SMC的细胞活力(n = 9);(B1)培养24小时和72小时的SMC的DAPI(蓝色),α-SMA(绿色)和OPN(红色)染色荧光图像;(B2)24小时和72小时SMCα-SMA的细胞粘附数统计(n = 3)(C1)DAPI(蓝色),CD206(绿色)和CD68(红色)染色MA(C2)细胞粘附的荧光图像ZE21B,MgF2,MgF2/PDA,S-HA NPs,S-HA/ASTA NPs-0.5,S-HA/ASTA NPs-1,S-HA/ASTA NPs-1.5和S-HA/ASTA NPs-2样品培养24小时和72小时的MA的粘附数统计(n = 3)(数据以平均值±SD和*表示,P<0.05,**P<0.01,***P<0.001,****P<0.0001,ns不显著)。
该图对平滑肌细胞(SMCs)与巨噬细胞(MA)进行了细胞相容性试验。结果表明,S-HA/ASTA NPs-1.5涂层对平滑肌细胞的表型呈现抑制作用,诱导巨噬细胞向CD206阳性(M2标志物)表达,表明涂层提升了巨噬细胞向抗炎功能。
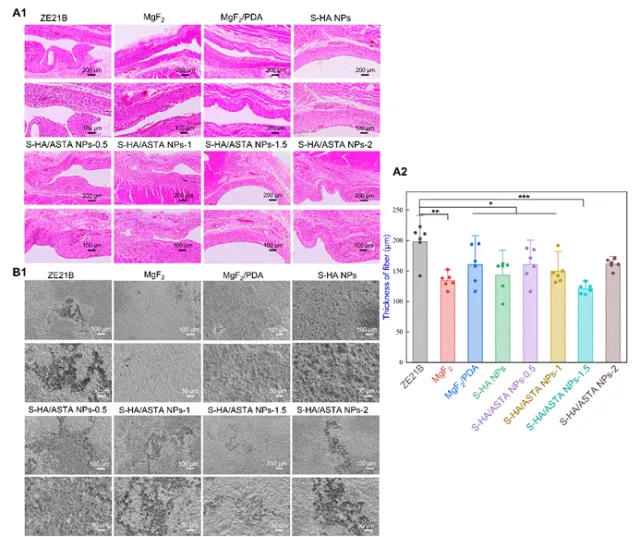
图8 在ZE21B上皮下植入S-HA/ASTA NPs涂层21天的分析:(A1)组织切片的组织病理学检查(HE)染色;(B1)没有腐蚀产物的样品的形态;(A2)纤维厚度(n = 6)(数据表示为平均值±SD&*P<0.05,**P<0.01,***P<0.001,****P<0.0001,ns不显著)。
该图对体内降解与组织反应进行了试验。组织病理学分析:S-HA/ASTA NPs-1.5组纤维化厚度显著低于其他组,表明其减轻了炎症反应。植入表面无腐蚀产物附着,表明涂层在体内环境中提升了材料的降解周期。

图9 在ZE21B上涂覆S-HA/ASTA NPs涂层的腹主动脉血管植入物28天的分析(A)横截面形态和具有腐蚀产物的EDS;(B1)去除腐蚀产物后的侧视图表面形态和点EDS;(B2)ZE21B,S-HA NPs和S-HA/ASTA NPs-1.5的元素组成(n = 3)
该图展示了植入的镁合金样品表面形貌和成分的分析结果。S-HA/ASTA NPs涂层通过形成均匀的保护层,减少了镁合金与腐蚀环境的直接接触,同时ASTA的抗氧化作用进一步抑制了降解。
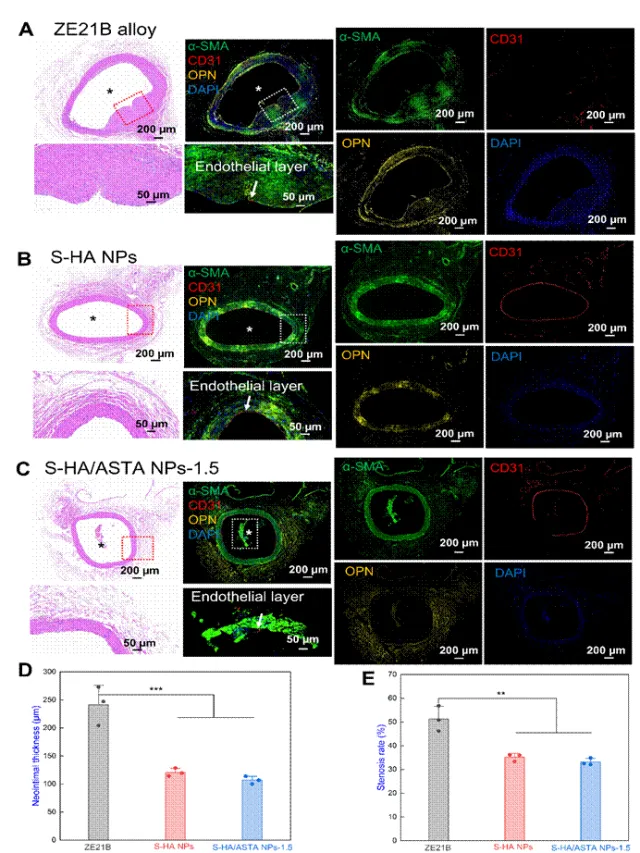
图10 在ZE21B上涂覆S-HA/ASTA NPs涂层的腹主动脉血管植入物28天的分析(A–C)组织病理学检查(HE)染色和用α-SMA(绿色),CD31(红色),OPN(黄色)染色的荧光图像)和DAPI(蓝色)在植入ZE21B线,S-HA NPs和S-HA/ASTA NPs-1.5后28天。(D)所有组的新内膜厚度(n = 3)的定量分析和(E)所有组(n = 3个组织切片/组)的狭窄百分比的定量分析(数据表示为平均值±SD和*P<0.05,**P<0.01,***P<0.001,****P<0.0001,ns不显著)。
该图对血管组织学进行了评价。在植入覆盖:S-HA/ASTA NPs-1.5涂层的镁合金后,血管管腔的直径降低最少,较好的抑制了血管狭窄。
【全文小结】
1. 多层涂层显著提升腐蚀抵抗力。研究表明,S-HA/ASTA NPs-1.5涂层显著提高了ZE21B镁合金的耐腐蚀性;
2. S-HA/ASTA NPs涂层优化表面特性。S-HA/ASTA NPs-1.5涂层具有最佳的亲水性(PDI < 0.2)和表面粗糙度(AFM分析),可以促进内皮细胞黏附和增殖。
4. 血液相容性与抗炎性效果提升。S-HA/ASTA NPs-1.5涂层减少血小板吸附与激活,抑制纤维蛋白原吸附和血栓形成,且血溶率最低(<3%),符合血液接触材料标准。
5. 体内降解控制与生物安全性。动物实验表明,S-HA/ASTA NPs-1.5涂层有效减缓镁合金降解速率,降低了炎症和血管狭窄,促进内皮层的修复。
【作者简介】

侯雅尘,女, 郑州大学第一附属医院助理研究员,工学博士,临床医学博士后。主要研究方向为可降解支架及其表面改性技术。近年来,主持河南省自然科学基金项目、河南省科技攻关项目等多项省部级项目,参与多项国家级和省部级重点项目。获得河南省第一届博士后创新创业大赛优胜奖及河南省创新创业优秀博士后称号。获得河南医学科技一等奖等荣誉。以第一或通讯作者发表10余篇SCI论文。国内发明专利授权4项,授权国际发明专利1项。

李敬安,男,郑州大学关绍康教授团队骨干教师(镁合金心脑血管支架涂层课题组负责人), 围绕镁合金心脑血管支架降解过快和生物功能不足等科学问题,开展表面涂层相关研究,在可降解镁合金支架类药性涂层研究方面取得一系列成果,主持和参与国家自然科学基金(含重点项目两项)和国家重点研发等多个项目,近三年(2023-至今)指导学生发表学术论文30余篇,其中多篇入选ESI高被引论文和热点论文。先后担任Advanced Materials等多部科学期刊审稿人。Wiley Publishing 书稿(专著)审稿人。H-index 39。指导河南省优秀学士论文一项,指导多名研究生获国家奖学金,郑州大学优研导师。

编辑:徐子越
校稿:乔双
审核:马雯
