
标题:NCAPH promotes immune evasion via inhibiting PD-L1 protein degradation in head and neck squamous cell carcinoma
IF:10.1
发表日期:2026年2月
作者单位:郑州大学第一附属医院&上海交通大学医学院
头颈部鳞状细胞癌(Head and Neck Squamous Cell Carcinoma, HNSCC)是全球第六大常见恶性肿瘤,预计到2030年新发病例将达到108万。该肿瘤起源于口腔、咽、喉等部位的黏膜上皮,在我国及东南亚地区发病率尤为突出。尽管手术切除、放化疗等传统治疗手段不断进步,但晚期或转移性HNSCC患者的预后仍然不佳。
近年来,以PD-1/PD-L1免疫检查点阻断(Immune Checkpoint Blockade, ICB)为代表的免疫治疗为肿瘤治疗带来革命性突破。FDA已于2016年批准帕博利珠单抗(Pembrolizumab)和纳武利尤单抗(Nivolumab)用于复发/转移性HNSCC的治疗。然而,临床数据显示,仅有部分患者能从免疫治疗中获益,多数患者因肿瘤免疫微环境(Tumor Microenvironment, TME)的免疫抑制特性而产生原发性耐药。
PD-L1蛋白的表达调控是决定免疫治疗疗效的关键因素。现有研究证实,PD-L1不仅受转录水平调控,其蛋白稳定性、降解途径及亚细胞定位同样影响肿瘤免疫逃逸能力。特别是在HNSCC中,PD-L1的高表达与CD8+T细胞耗竭密切相关。因此,深入解析PD-L1蛋白的翻译后修饰机制,寻找新的治疗靶点,对于克服免疫治疗耐药、改善患者生存具有重要意义。
本研究聚焦于非SMC凝缩蛋白I复合体亚基H(Non-SMC Condensin I Complex Subunit H, NCAPH)。作为染色体凝缩素复合体的核心组分之一,NCAPH主要参与有丝分裂过程中染色体的正确分离。值得注意的是,NCAPH在多种实体瘤中呈现异常高表达,但其是否参与肿瘤免疫微环境的调控,此前尚无报道。研究团队通过跨癌种关联分析发现,NCAPH在HNSCC组织中显著高表达,且与患者不良预后密切相关,提示其可能通过非经典功能参与肿瘤免疫逃逸。
本研究采用多维度实验策略,从分子、细胞、动物及临床样本四个层面系统阐述NCAPH的免疫功能:
分子生物学技术:利用免疫共沉淀(Co-IP)、免疫荧光共定位、蛋白质半衰期测定(CHX chase assay)及泛素化检测,明确NCAPH与PD-L1的蛋白相互作用模式及其对PD-L1降解途径的影响。
细胞功能实验:通过CCK-8、克隆形成、BrdU掺入实验评估细胞增殖能力;采用划痕愈合及Transwell实验检测细胞迁移能力;利用流式细胞术分析细胞周期分布及PD-L1膜表达水平;建立PBMC与肿瘤细胞共培养体系,评估T细胞杀伤功能。
动物模型构建:建立CNE2细胞裸鼠皮下移植瘤模型评估肿瘤生长;构建C57BL/6小鼠同源移植瘤模型(SCCVII、LLC、B16)研究免疫微环境;采用CD8α单克隆抗体清除实验验证CD8+T细胞在抗肿瘤免疫中的必要性。
临床样本分析:收集HNSCC患者组织样本进行免疫组化染色,分析NCAPH与PD-L1蛋白表达的相关性;利用TCGA、GEO等公共数据库进行生物信息学挖掘,验证NCAPH的预后价值及免疫浸润相关性。
药物干预策略:通过分子对接筛选潜在抑制剂;设计并合成细胞穿透肽NPIDP(NCAPH and PD-L1 Interaction Disrupting Peptide);评估拓扑替康(Topotecan)对NCAPH蛋白稳定性的影响。
本研究的技术路线遵循"表型发现—机制解析—靶点验证—干预策略"的逻辑链条:
第一阶段:生物信息学筛选与临床验证利用CVAA(Cross-Value Association Analysis)方法分析泛癌种数据→锁定NCAPH在HNSCC中高表达→TCGA数据库验证其与病理分级、淋巴结转移及预后的相关性→临床组织芯片IHC染色确认蛋白表达特征。
第二阶段:功能表型研究构建NCAPH敲低/过表达细胞系→评估对细胞增殖、周期、迁移及放疗敏感性的影响→裸鼠移植瘤实验验证体内促癌作用。
第三阶段:免疫调控机制解析转录组测序及GSEA分析提示免疫相关通路异常→检测免疫检查点分子表达→发现NCAPH特异性调控PD-L1蛋白水平→Co-IP鉴定NCAPH与PD-L1直接结合→竞争实验揭示NCAPH与HIP1R(Huntingtin-interacting protein 1-related)竞争性结合PD-L1→溶酶体抑制剂挽救实验证实NCAPH阻断PD-L1的溶酶体降解途径。
第四阶段:转化应用研究基于NCAPH 271-360aa与PD-L1 260-290aa结合域设计NPIDP肽段→体外验证其阻断NCAPH-PD-L1相互作用→体内联合PD-1抗体治疗评估协同效应→药物重定位筛选发现拓扑替康可诱导NCAPH泛素化降解→评估拓扑替康联合免疫治疗的临床转化潜力。
研究团队首先通过TCGA数据库分析发现,HNSCC肿瘤组织中NCAPH mRNA水平显著高于正常组织(P=2e-15),且与肿瘤分级(G1-G4)及淋巴结转移状态(N0-N3)呈正相关。免疫组化结果显示,65.6%(143/218)的HNSCC样本呈NCAPH阳性表达,而正常组织仅27.3%(9/33)阳性。生存分析表明,NCAPH高表达患者总生存期(OS)和无进展生存期(PFS)显著缩短,ROC曲线显示其AUC值达0.938,提示NCAPH可作为HNSCC的独立预后生物标志物。
细胞实验证实,与正常鼻咽上皮细胞NP69相比,HNSCC细胞系(CNE1、CNE2、CAL27等)中NCAPH蛋白水平普遍升高。通过慢病毒介导的shRNA敲低NCAPH后,CNE2和CAL27细胞的克隆形成能力显著下降,BrdU阳性细胞比例减少,流式细胞术显示G2/M期细胞比例增加,伴随p21上调及CDK1磷酸化水平降低,表明NCAPH缺失可诱导细胞周期阻滞,抑制肿瘤细胞增殖。
划痕愈合实验和Transwell迁移实验显示,NCAPH敲低显著抑制CAL27和CNE2细胞的迁移能力,伴随上皮-间质转化(EMT)标志物改变(E-cadherin上调,N-cadherin和Vimentin下调)。细胞骨架染色显示,NCAPH缺失导致肿瘤细胞丝状伪足(filopodia)数量减少,提示其参与细胞运动结构的调控。
在放疗敏感性方面,克隆形成实验表明,NCAPH敲低细胞在2-6 Gy照射后的存活分数显著降低。流式细胞术检测Annexin V/PI双染显示,NCAPH缺失联合放疗显著增加细胞凋亡率,Western blot证实cleaved PARP、Bax和p53表达上调,Bcl-2下调。裸鼠皮下移植瘤实验进一步验证,NCAPH敲低组肿瘤体积和重量显著小于对照组,免疫组化显示Cleaved Caspase 3(CC3)阳性细胞增多,证实NCAPH在体内促进肿瘤生长并抑制放疗诱导的凋亡。
生物信息学分析揭示,NCAPH高表达与肿瘤纯度正相关,与CD8+T细胞浸润水平负相关。ESTIMATE算法计算显示,NCAPH与免疫评分(ImmuneScore)、基质评分(StromalScore)呈负相关,而与免疫抑制细胞评分正相关。值得注意的是,这一现象在肺腺癌和黑色素瘤中同样存在,但在结肠癌中未观察到,提示NCAPH的免疫功能具有组织特异性。
体外T细胞杀伤实验显示,NCAPH敲低的HNSCC细胞对PBMC介导的细胞毒性敏感性显著增加。机制探索发现,NCAPH敲低特异性降低PD-L1蛋白表达,而对PD-L2和B7-H3无影响;流式细胞术证实细胞膜表面PD-L1水平下降,但qRT-PCR显示PD-L1 mRNA水平无变化,提示NCAPH在翻译后水平调控PD-L1。临床样本分析显示,NCAPH与PD-L1蛋白表达呈显著正相关(R=0.468, P<0.001),而在TCGA数据库中两者mRNA无相关性,进一步支持蛋白水平的调控机制。
在C57BL/6小鼠SCCVII同源移植瘤模型中,NCAPH敲低显著抑制肿瘤生长,且伴随CD8+T细胞浸润增加和Granzyme B(GZMB)释放增强。使用CD8α单克隆抗体清除CD8+T细胞后,NCAPH敲低的抗肿瘤效应被显著逆转,证实CD8+T细胞在该过程中起关键作用。免疫组化显示,NCAPH敲低组肿瘤中PD-L1表达降低,GZMB阳性细胞增多。
更重要的是,NCAPH敲低与PD-1抗体联合治疗产生显著协同效应,肿瘤抑制效果优于单药治疗。这一结果在LLC(肺癌)和B16(黑色素瘤)模型中得到验证,提示靶向NCAPH可能广泛增强实体瘤对免疫检查点抑制剂的敏感性。
NCAPH竞争性抑制HIP1R介导的PD-L1降解放线菌酮(CHX)追踪实验显示,NCAPH敲低显著缩短PD-L1蛋白半衰期。蛋白酶体抑制剂MG132未能挽救NCAPH敲低引起的PD-L1下降,而自噬/溶酶体抑制剂氯喹(Chloroquine, CQ)可恢复PD-L1水平,提示NCAPH抑制PD-L1的溶酶体降解途径。免疫荧光显示,NCAPH与PD-L1在胞质中共定位,NCAPH敲低后PD-L1与溶酶体标志物LAMP1的共定位显著增加。
Co-IP实验证实NCAPH与PD-L1直接相互作用。文献报道HIP1R、CMTM6和ZDHHC3均参与PD-L1稳定性调控。本研究发现,NCAPH敲低显著增强PD-L1与HIP1R的结合,而不影响与CMTM6或ZDHHC3的相互作用。过表达NCAPH可竞争性抑制HIP1R与PD-L1的结合。进一步实验证实,HIP1R敲低可逆转NCAPH缺失引起的PD-L1下降,证实NCAPH通过竞争性结合PD-L1,阻断HIP1R介导的PD-L1溶酶体降解,从而稳定PD-L1蛋白。
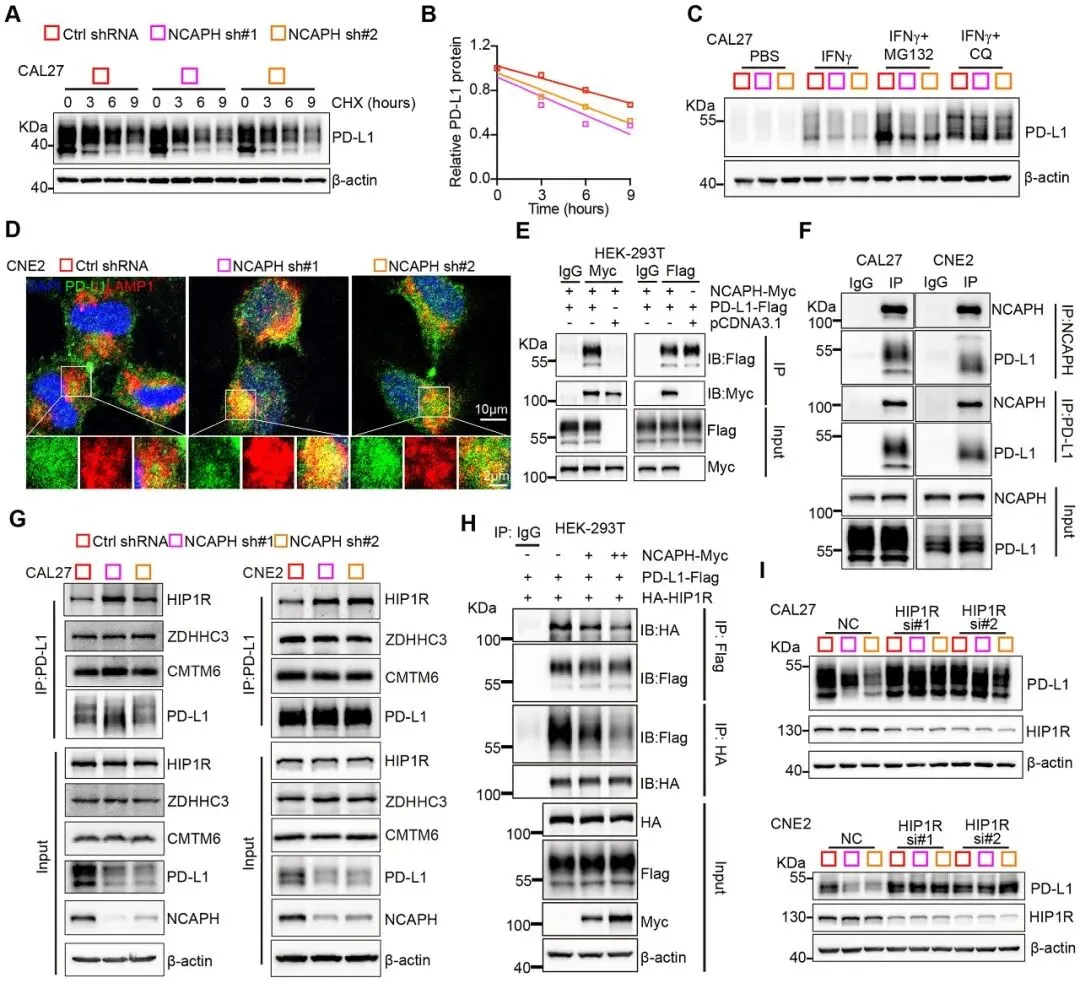
通过截短突变体Co-IP实验,研究者鉴定出PD-L1的胞内域(260-290aa)和NCAPH的271-360aa区域为关键结合位点。基于此,研究团队设计并合成了一种融合肽NPIDP(NCAPH 271-360aa融合细胞穿透肽iRGD),旨在竞争性阻断内源性NCAPH与PD-L1的相互作用。
体外pull-down实验证实NPIDP可直接结合PD-L1。在CAL27和CNE2细胞中,NPIDP处理显著破坏NCAPH-PD-L1相互作用,同时增强HIP1R-PD-L1结合,促进PD-L1降解。重要的是,NPIDP本身不影响肿瘤细胞增殖,但显著增强PBMC对肿瘤细胞的杀伤活性。体内实验显示,NPIDP单药治疗可抑制SCCVII肿瘤生长,与PD-1抗体联合使用时产生协同抗肿瘤效应,伴随肿瘤内CD8+T细胞浸润增加和GZMB释放。安全性评估显示,NPIDP治疗未引起小鼠体重下降或主要器官形态学改变。
为寻找可临床转化的小分子抑制剂,研究团队利用GDSC和CTD数据库进行药物筛选,结合分子对接分析(CB-Dock),发现拓扑替康(Topotecan)与NCAPH具有潜在结合能力(Vina score=-7.8)。拓扑替康是FDA批准的拓扑异构酶I抑制剂,用于小细胞肺癌和卵巢癌治疗。
实验证实,拓扑替康处理可剂量依赖性降低NCAPH蛋白水平,但不影响其mRNA水平。MG132可挽救拓扑替康诱导的NCAPH降解,CHX实验显示拓扑替康缩短NCAPH蛋白半衰期。Co-IP证实拓扑替康促进NCAPH的泛素化修饰,提示其通过蛋白酶体途径诱导NCAPH降解。
功能实验显示,拓扑替康处理降低PD-L1总蛋白及膜表面表达水平,增强T细胞介导的肿瘤细胞杀伤。在体内SCCVII模型中,拓扑替康单药或联合PD-1抗体均显著抑制肿瘤生长,增加CD8+T细胞浸润和GZMB表达。毒性评估显示,治疗剂量拓扑替康未引起明显体重下降或器官损伤。值得注意的是,拓扑替康在HNSCC细胞中的IC50值显著低于正常鼻咽上皮细胞NP69,提示其对肿瘤细胞具有一定的选择性毒性。
本研究首次揭示了染色体凝缩蛋白NCAPH在肿瘤免疫逃逸中的非经典功能,建立了"NCAPH-HIP1R-PD-L1"调控轴,为HNSCC的免疫治疗提供了新的理论基础和干预靶点。
理论创新:
突破了NCAPH仅参与细胞分裂的传统认知,发现其通过调控PD-L1蛋白稳定性参与免疫微环境塑造;
阐明了HIP1R介导的PD-L1溶酶体降解途径在HNSCC中的调控机制,揭示了竞争性结合在免疫检查点调控中的新模式;
提出了NCAPH作为"冷肿瘤"向"热肿瘤"转化调控因子的新概念。
转化价值:
生物标志物:NCAPH可作为HNSCC预后评估和免疫治疗疗效预测的标志物,高表达提示免疫治疗耐药;
肽类药物治疗:NPIDP作为首个靶向NCAPH-PD-L1相互作用的干扰肽,为克服免疫治疗耐药提供了新的生物制剂候选;
老药新用:发现拓扑替康通过降解NCAPH增强抗肿瘤免疫,为HNSCC的联合治疗方案提供了循证医学证据,有望快速进入临床试验。
临床启示: 对于NCAPH高表达的HNSCC患者,可考虑联合使用拓扑替康与PD-1/PD-L1抗体;对于放疗抵抗的局部晚期患者,靶向NCAPH可能增强放疗敏感性。未来可开发针对NCAPH 271-360aa表位的单克隆抗体,或筛选更强效的小分子抑制剂。
研究通过系统的功能实验和机制研究,构建了完整的NCAPH调控肿瘤免疫逃逸的信号网络。NCAPH在HNSCC中的高表达不仅促进肿瘤细胞自主的恶性表型(增殖、迁移、放疗抵抗),更重要的是通过稳定PD-L1蛋白,构建免疫抑制性微环境。这种"双重打击"效应使得NCAPH成为极具潜力的治疗靶点。
关键科学问题的回答:
为什么NCAPH不影响PD-L1转录? 研究表明NCAPH与PD-L1 mRNA水平无相关性,提示其主要在蛋白水平发挥作用,这与HIP1R介导的蛋白降解途径相吻合。
NPIDP的安全性如何? 初步毒理学评估显示无明显副作用,但长期影响和免疫原性需进一步验证。
拓扑替康的特异性? 虽然拓扑替康主要靶向拓扑异构酶I,但本研究证实其可结合并促进NCAPH降解,这种多靶点效应可能协同增强抗肿瘤活性。
局限性与未来方向:
本研究主要使用小鼠同源移植瘤模型,未来需在转基因自发瘤模型或人源化PDX模型中验证;
NCAPH与PD-L1结合的具体氨基酸位点尚需晶体结构解析精准确认;
拓扑替康的最佳给药剂量、方案及与免疫治疗的时间窗需通过临床试验确定;
需探索NCAPH在其他免疫治疗耐药实体瘤(如NSCLC、黑色素瘤)中的普适性。
结语: 随着精准医学的发展,针对肿瘤微环境的联合治疗已成为提高免疫治疗疗效的关键策略。本研究不仅揭示了NCAPH作为HNSCC治疗靶点的科学价值,更为临床实践提供了"靶向NCAPH+免疫检查点阻断"的联合治疗新思路。未来基于NCAPH抑制剂的开发,有望为晚期头颈鳞癌患者带来新的生存希望。
欢迎关注烊树生物,每周分享国自然相关热点文献,拓展科研思路!—END—
内容为【烊树生物】公众号原创,
转载请写明来源于【烊树生物】
特色技术服务:
✅ 单项课题设计指导外包服务
✅ 常规/个性化实验服务
✅ 国自然基金结题指导服务
烊树生物&赛瑞格生物可提供技术实验服务:
生信分析:单细胞&空转 RNA-seq、ATAC-seq 和数据处理、基于细胞因子分泌的 CD4 淋巴细胞分离、转录组测序分析 等
组学实验:脂质组学分析、蛋白质印迹分析 等
常规分子实验:慢病毒介导的表达和短发夹 RNA 介导的沉默、CRISPR 介导的基因敲除、qRT-PCR 检测、ELISA、免疫荧光染色 等
细胞实验:流式细胞术、细胞培养和细胞共培养、细胞死亡检测、电子显微镜、脂质过氧化的测量、细胞毒性检测、酶联免疫吸附试验、Boyden 趋化性测定、Microslide 趋化性测定、离体肿瘤切片迁移测定 等
动物模型及病理分析:自发性肿瘤发生小鼠模型、免疫荧光共聚焦成像、病理切片、免疫组化分析 等