郑州大学Cell Stem Cell | 揭示熬夜如何“伤肠道”
- 2026-02-09 10:00:17
欢迎关注类器官前言(沿)进展,第一时间了解类器官领域(生物学、癌症生物学、人工智能、材料学、仿生学)的新进展;同时跟进国际国内相关行业的发展信息
▍导语 | 揭示睡眠紊乱通过迷走神经–5-HT轴直接破坏肠道干细胞
睡眠障碍与炎症性肠病(IBD)、肠易激综合征(IBS)等多种胃肠疾病密切相关,但长期以来,一个关键问题始终悬而未决:睡眠紊乱究竟是如何从中枢神经系统出发,跨越解剖与组织层级,直接作用于肠道上皮乃至肠道干细胞的?
2026 年 2 月,郑州大学团队联合中国农业大学、中国科学院深圳先进技术研究院及美国加州大学欧文分校的研究人员,在 Cell Press 旗下期刊《Cell Stem Cell》 发表研究论文《Sleep disturbance triggers aberrant activation of vagus circuitry and induces intestinal stem cell dysfunction》。该研究首次从中枢神经环路的角度,系统揭示了睡眠剥夺如何通过延髓迷走神经背侧运动核(DMV)异常激活,驱动迷走神经—乙酰胆碱—肠道 5-羟色胺(5-HT)信号级联,最终诱导肠道干细胞氧化应激和功能障碍,从而破坏肠道上皮稳态。
这项工作不仅为“睡眠—肠道”关联提供了明确的神经生物学机制,也将肠道干细胞置于睡眠紊乱相关胃肠疾病发生发展的核心位置。

▍研究新颖性|
这项研究的突破不在于“睡眠不足会影响肠道”这一现象本身,而在于首次明确了睡眠信号如何通过一个具体的中枢神经核团,被精准传递到肠道干细胞层面。
过去的研究多集中于炎症、免疫或微生物群变化,而该工作提出了一个更直接的机制:
睡眠剥夺并非“全身应激”式地影响肠道
而是通过 延髓迷走神经背侧运动核(DMV) 的异常持续激活
触发 迷走神经—乙酰胆碱(ACh)—肠嗜铬细胞—5-HT 这一神经内分泌级联
最终直接作用于肠道干细胞(ISC),诱发氧化应激和翻译应激,破坏上皮稳态
这是首次将睡眠障碍与肠道干细胞命运调控在神经环路层面完整串联起来。
▍研究科学背景与现状|
肠道上皮是人体更新最快的组织之一,其稳态完全依赖于位于隐窝底部的肠道干细胞(ISC)。这些细胞不仅维持日常更新,还决定了损伤后的再生能力。
已有研究表明:
睡眠不足与 IBD、IBS 发病风险显著升高相关
果蝇和小鼠中,睡眠剥夺可导致肠道 ROS 特异性积累
但关键问题始终未解:中枢睡眠信号如何跨越解剖屏障,精准作用于 ISC?
另一方面,肠道是体内最大的 5-HT 产生器官,约 90–95% 的 5-HT 来自肠嗜铬细胞。5-HT 在生理状态下参与蠕动、分泌和神经反馈,但其水平必须被严格控制。这项研究正是在这两个研究脉络的交叉点上展开。
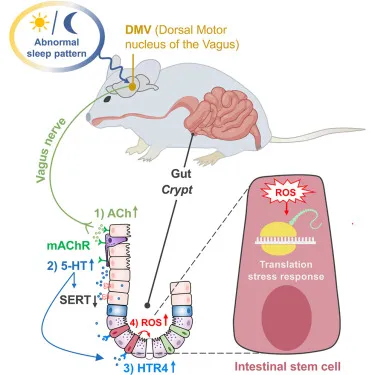
▍研究科学技术路线|
作者采用了一条自上而下、由表型到机制的技术路线:
建立急性睡眠剥夺小鼠模型(机械转杆 + EEG/EMG 验证)
系统评估肠道结构、细胞组成与 ISC 功能
多组学解析(蛋白组 + 靶向代谢组)寻找关键分子变化
类器官、遗传模型与药理干预逐级验证因果关系
通过迷走神经切断、病毒追踪、光纤记录和化学遗传学,反向定位中枢神经源头
这是一项典型的“神经—器官—干细胞”多尺度整合研究。
▍研究结果|
Figure 1|短期睡眠剥夺直接损伤 ISC 与上皮更新
两天睡眠剥夺即可引起明显的肠道结构变化:绒毛变短、隐窝变浅,Ki67⁺ 增殖细胞显著减少。更重要的是,Lgr5⁺ 和 Olfm4⁺ 干细胞数量明显下降。
BrdU 追踪显示,上皮细胞沿隐窝—绒毛轴的迁移显著减慢;类器官实验进一步证明,这种损伤是ISC 功能内在下降,而非单纯的微环境效应。
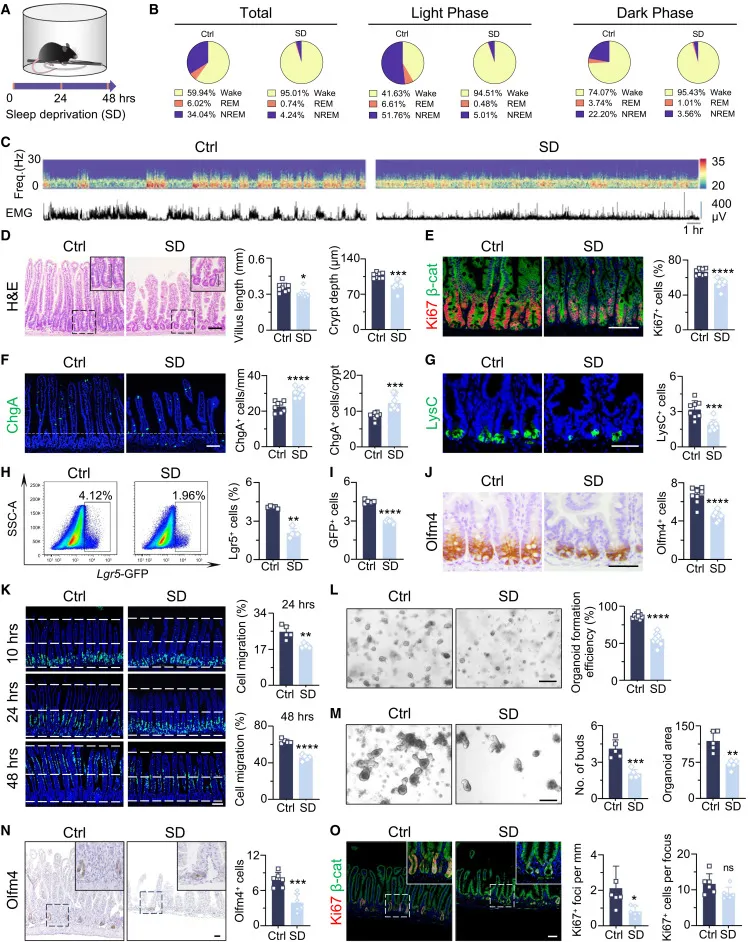
Figure 2|ISC 中翻译应激与氧化应激被激活
蛋白组学结果显示,睡眠剥夺后隐窝细胞中最显著富集的是“应激诱导的翻译抑制通路”。
p-eIF2α 升高、应激颗粒(G3BP1/TIA1)形成、自噬体累积,表明 ISC 进入典型的ISR(Integrated Stress Response)状态。同时,ROS 在肠道中特异性升高,而非全身普遍现象。
抗氧化剂(VC、NAC)能够系统性缓解这些表型,说明 氧化应激是上游驱动因素。
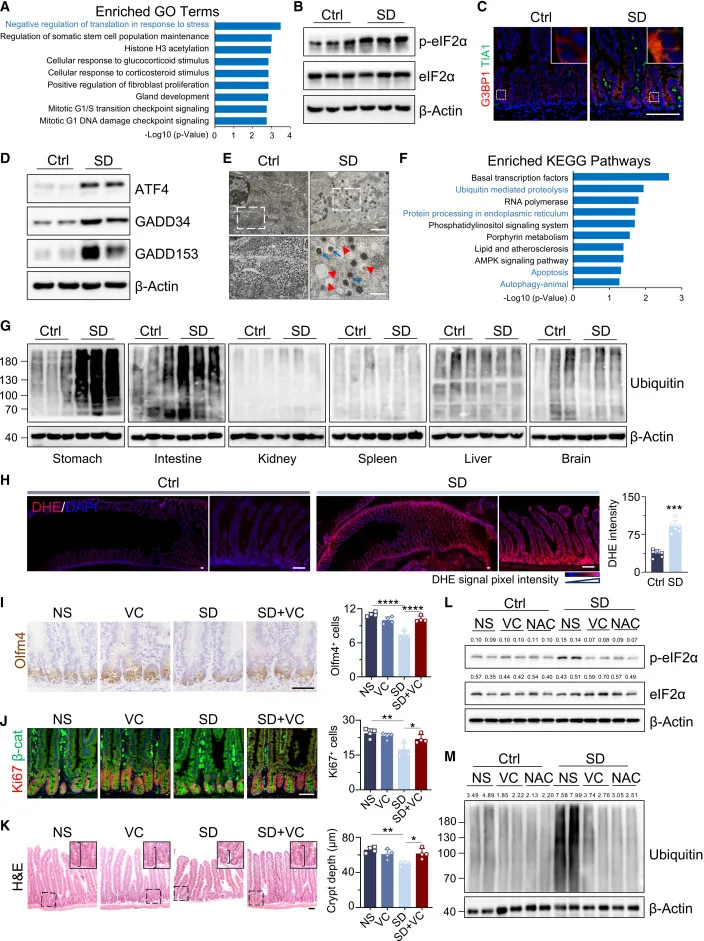
Figure 3|睡眠剥夺导致肠道 5-HT 异常升高
靶向代谢组学清楚显示,5-HT 及其前体在肠道中显著升高。体内注射 5-HT 可几乎完整复现睡眠剥夺的肠道表型,而 Tph1⁻/⁻ 小鼠 在睡眠剥夺条件下受到显著保护。
这说明 肠嗜铬细胞来源的 5-HT 是关键致病信号。
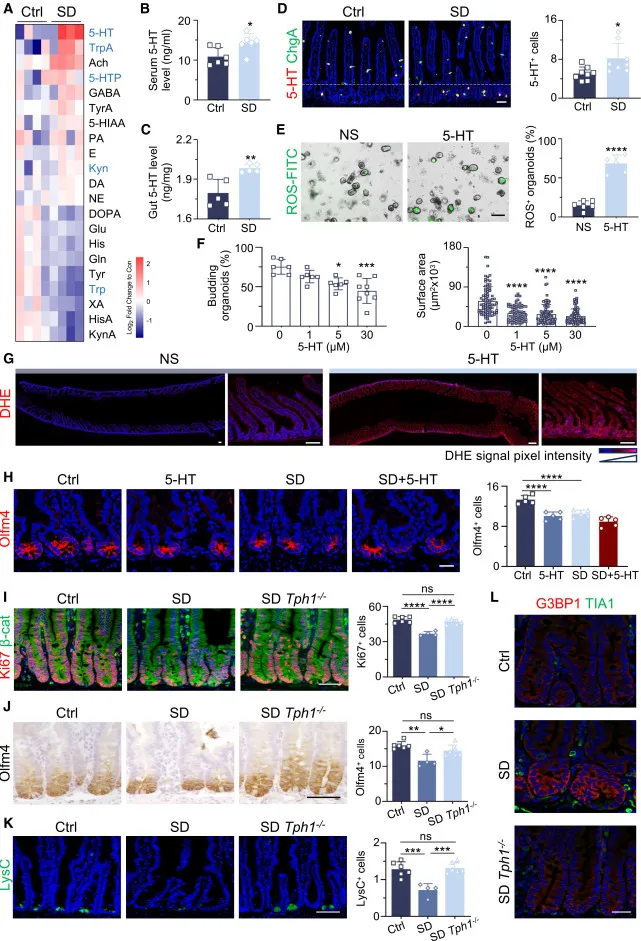
Figure 4|ISC 通过 HTR4 感知 5-HT
单细胞转录组数据显示,ISC 中高表达的 5-HT 受体是 HTR4。无论是药理激动还是遗传敲除,HTR4 都被证明是 5-HT → ROS → ISC 功能障碍的必要节点。
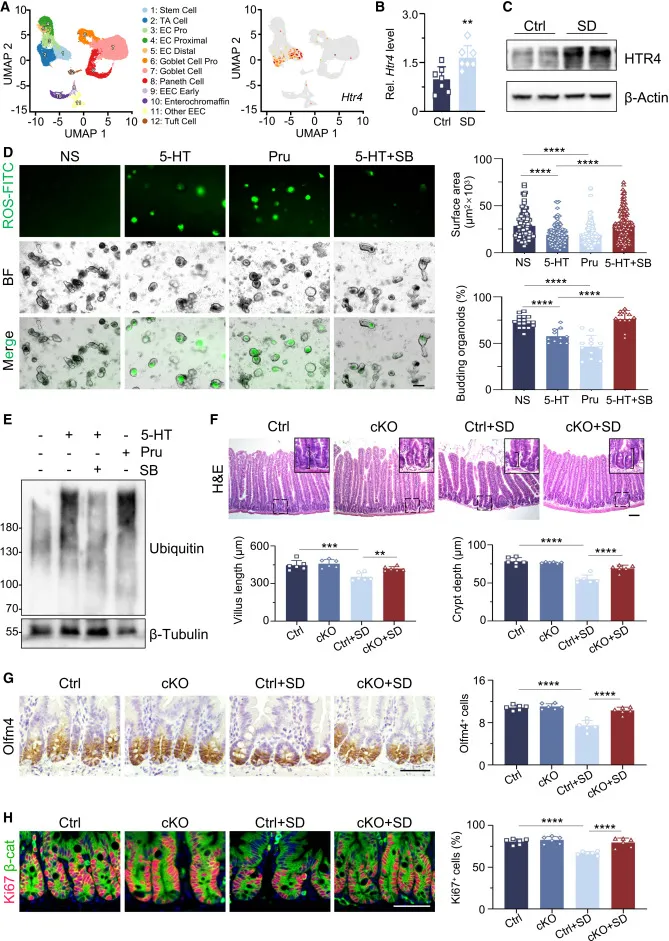
Figure 5–7|DMV–迷走神经是中枢源头
切断迷走神经可以完全阻断睡眠剥夺诱导的肠道损伤。PRV 逆行示踪和钙成像进一步确认:DMV 是唯一将睡眠信号传递到肠道的中枢核团。
DMV 神经元的异常激活具有持续性,即便恢复睡眠,其活性仍可维持数天。
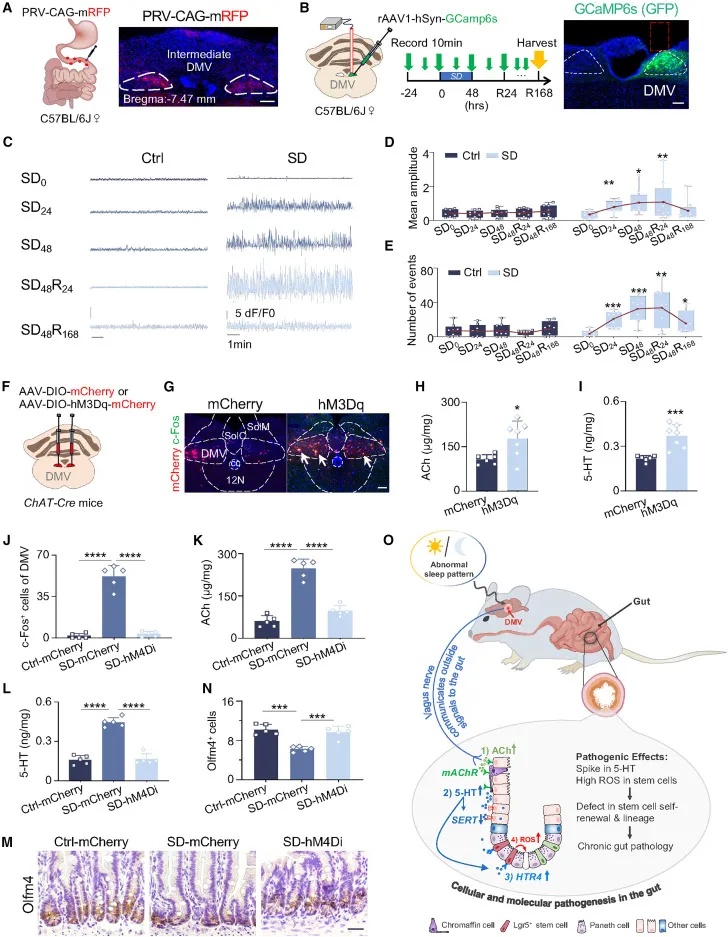
▍研究讨论与局限性|
目前无法完全解析 DMV 与肠上皮之间是否存在直接突触连接
DMV 上游如何感知“睡眠不足”仍有待进一步研究
本研究聚焦急性睡眠剥夺,慢性睡眠障碍的长期影响尚未系统评估
尽管如此,这项工作已经建立了一个高度自洽的机制框架。
这项研究最重要的贡献在于提出:
睡眠并非仅影响大脑或免疫系统,而是通过可塑性极强的神经环路,直接决定干细胞命运。
DMV–ACh–5-HT–HTR4 这一轴线,可能成为未来治疗睡眠相关胃肠疾病的新干预靶点。
