肝癌免疫治疗新突破!郑州大学/南京医科大学团队 2026 z年 14.1 分发刊,新型 CAR-NKT 细胞外囊泡,攻克肝癌的新一代免疫治疗利器
- 2026-02-09 19:50:00

医研新境
课题、实验、培训 全流程设计
欢迎扫码咨询
微信号丨ztsw0925
抖音丨92749311371
导 读

肝细胞癌(HCC)作为全球高死亡率的恶性肿瘤之一,传统治疗手段疗效有限,且 CAR-T 等细胞免疫疗法面临细胞因子释放综合征、脱靶效应等严重副作用。郑州大学、南京医科大学等团队在《Advanced Science》发表的最新研究,开发出靶向TM4SF1的纳米抗体修饰 CAR-NKT 细胞外囊泡(CAR⁴SF¹-EVs)。该疗法不仅能精准杀伤肿瘤细胞、重塑肿瘤免疫微环境,还能与免疫检查点抑制剂协同作用,诱导长效抗肿瘤免疫记忆,为实体瘤治疗提供了兼具安全性与有效性的全新策略。
Part.1
研究背景解读

CAR-T 细胞疗法在血液瘤中疗效显著,但用于实体瘤时,存在严重的细胞因子释放综合征(CRS)、脱靶毒性、移植物抗宿主病(GvHD)等问题,限制了其临床应用。
自然杀伤 T 细胞(NKT 细胞)具有天然的肿瘤靶向性,且 GvHD 风险低,但 NKT 细胞在体内含量稀少,异体产品易被宿主免疫系统排斥,难以大规模应用。
细胞外囊泡(EVs)的独特优势
细胞外囊泡是细胞分泌的纳米级颗粒,直径约 100-200nm,可穿透实体瘤的物理屏障,克服肿瘤微环境的阻碍。
与传统 CAR 细胞疗法相比,CAR-EVs 无活细胞成分,不会引发 GvHD,且能显著降低细胞因子相关毒性,同时保留对肿瘤细胞的特异性杀伤能力。
TM4SF1:理想的肿瘤靶向靶点
TM4SF1 是一种四跨膜糖蛋白,在肝癌等 16 种恶性肿瘤细胞表面高表达,而在正常组织中几乎检测不到,具备高度的肿瘤特异性。
传统单链可变片段(scFv)抗体存在分子量大、肿瘤穿透性差、种属交叉反应弱等缺陷,纳米抗体(Nb)分子量小(约 15kDa)、稳定性高、免疫原性低,更适合用于 CAR-EVs 的靶向修饰。
Part.2
研究思路解析

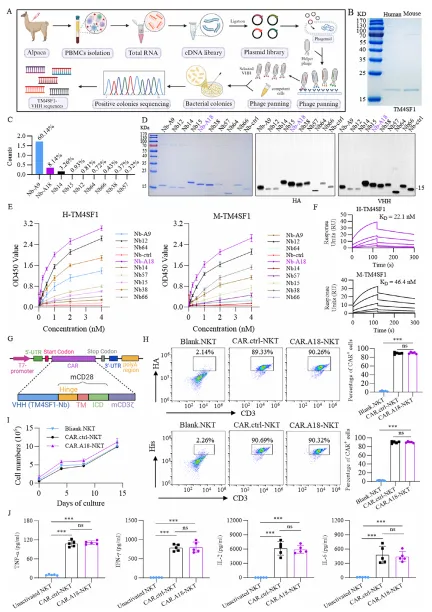
以人源 TM4SF1 蛋白为抗原,通过羊驼纳米抗体噬菌体展示文库进行三轮淘选,获得 9 种候选纳米抗体。 经 ELISA 和表面等离子体共振(SPR)验证,筛选出对人源和鼠源 TM4SF1 均具有高亲和力的 A18 纳米抗体(人源 KD=22.1nM,鼠源 KD=46.4nM)。
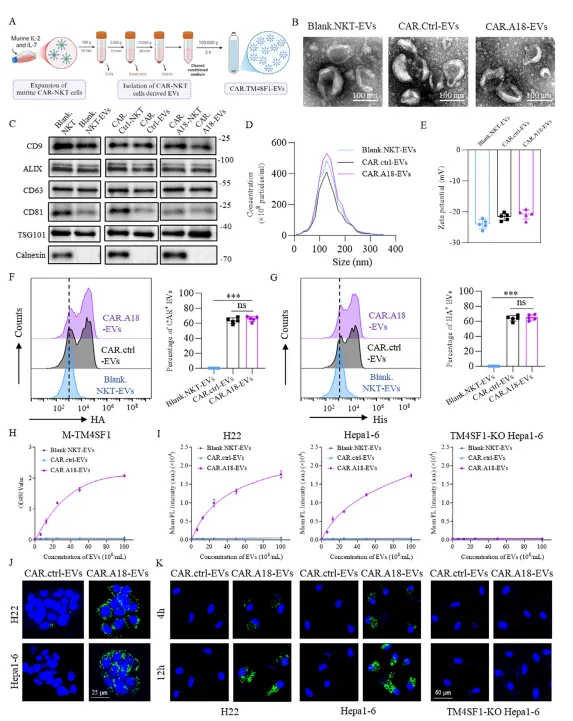
从 C57BL/6J 小鼠脾脏分离 NKT 细胞,通过逆转录病毒将 A18 纳米抗体整合到 CAR 结构中,构建 CAR⁴SF¹-NKT 细胞。 体外扩增 CAR⁴SF¹-NKT 细胞,收集培养上清液,通过超速离心法分离纯化得到 CAR⁴SF¹-EVs,并鉴定其形态、标志物及表面 CAR 蛋白表达。
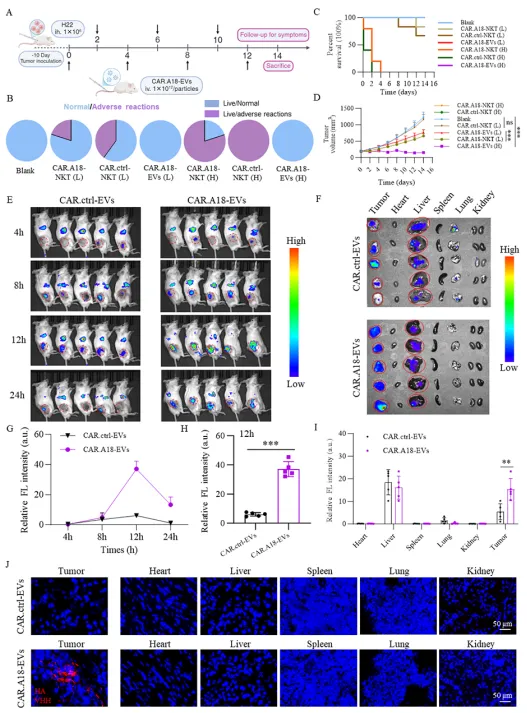
利用 ELISA、免疫荧光和活体成像技术,验证 CAR⁴SF¹-EVs 对 TM4SF1 高表达肿瘤细胞的特异性结合能力及体内肿瘤靶向性。 通过高低剂量对比实验,评估 CAR⁴SF¹-EVs 与 CAR-NKT 细胞在小鼠模型中的毒性差异,明确其安全性优势。
从诱导免疫原性细胞死亡(ICD)、重塑肿瘤免疫微环境、激活 CD8⁺T 细胞等角度,解析 CAR⁴SF¹-EVs 的抗肿瘤机制。 开展 CAR⁴SF¹-EVs 与 PD-1/CTLA-4 抑制剂的联合治疗实验,验证协同增效作用及长效免疫记忆的形成。
Part.3
主要研究结果展示

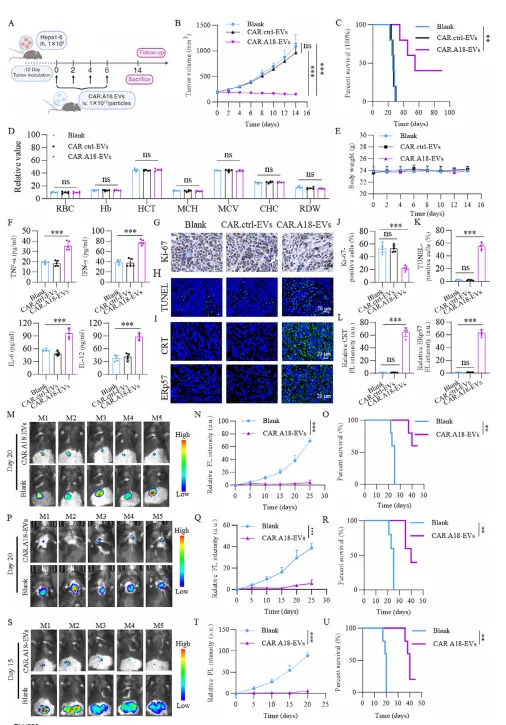
靶向性:CAR⁴SF¹-EVs 可特异性结合 TM4SF1 高表达的 H22、Hepa1-6 肝癌细胞,而不结合 TM4SF1 敲除的肿瘤细胞;活体成像显示,CAR⁴SF¹-EVs 在注射后 12h 在肿瘤部位达到富集峰值,且在正常组织中分布极少。
安全性:高剂量 CAR-NKT 细胞注射导致小鼠 14 天内 100% 死亡,而高低剂量 CAR⁴SF¹-EVs 组均无小鼠死亡或明显不良反应,血常规和组织病理检测显示各器官无异常。
CAR⁴SF¹-EVs 通过内质网应激诱导肿瘤细胞发生 ICD
CAR⁴SF¹-EVs 处理后,肿瘤细胞表面钙网蛋白(CRT)、ERp57 表达上调,同时释放 ATP、HMGB1 等损伤相关分子模式(DAMPs),符合 ICD 的典型特征。
机制研究表明,CAR⁴SF¹-EVs 携带的 FasL 是关键效应分子,通过激活内质网应激通路,诱导肿瘤细胞凋亡;抑制内质网应激可显著削弱其抗肿瘤效果。
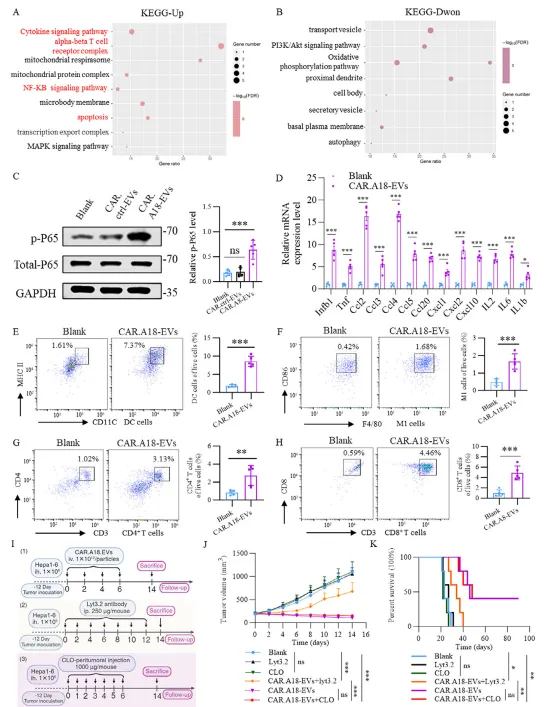
CAR⁴SF¹-EVs 重塑肿瘤免疫微环境,依赖 CD8⁺T 细胞发挥作用
RNA 测序结果显示,CAR⁴SF¹-EVs 处理后,肿瘤组织中细胞因子信号通路、NF-κB 通路显著激活,促炎细胞因子(TNF-α、IFN-γ)和趋化因子表达上调。
流式细胞术检测发现,肿瘤微环境中成熟树突状细胞、M1 型巨噬细胞、CD4⁺T 细胞和 CD8⁺T 细胞浸润显著增加;耗竭 CD8⁺T 细胞后,CAR⁴SF¹-EVs 的抗肿瘤效果明显减弱,证实 CD8⁺T 细胞是其发挥作用的核心。
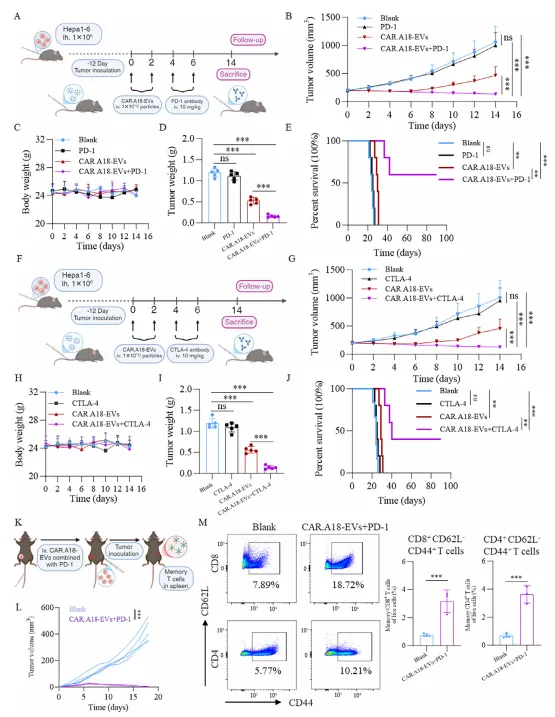
CAR⁴SF¹-EVs 与免疫检查点抑制剂协同增效,诱导长效免疫记忆
单独使用 PD-1 或 CTLA-4 抑制剂对肝癌模型的治疗效果有限,而与 CAR⁴SF¹-EVs 联合使用后,肿瘤体积显著缩小,小鼠生存期大幅延长。
联合治疗组小鼠在肿瘤完全消退后,再次接种肿瘤细胞时无肿瘤生长,且脾脏中 CD4⁺和 CD8⁺效应记忆 T 细胞比例显著升高,表明成功诱导了长效抗肿瘤免疫记忆。
Part.4
总 结

https://advanced.onlinelibrary.wiley.com/doi/epdf/10.1002/advs.202521623